Amonyak
CAS ID#: 7664-41-7
Etkilenen Organ Sistemleri: Solunum (Burundan Akciğerlere)
Kanser Sınıflandırması: Lütfen kanser ve kanser sınıflandırması ile ilgili sorularınız için NTP , IARC veya EPA ile iletişime geçin .
Kimyasal Sınıflandırma: Yok
Özet: Amonyak doğal olarak oluşur ve insan faaliyetleriyle üretilir. Bitki ve hayvanların ihtiyaç duyduğu önemli bir azot kaynağıdır. Bağırsaklarda bulunan bakteriler amonyak üretebilir.
Amonyak, çok belirgin bir kokuya sahip renksiz bir gazdır. Bu koku birçok kişiye tanıdık gelir çünkü amonyak tuzları koklamakta, birçok ev ve endüstriyel temizleyicide ve pencere temizleme ürünlerinde kullanılır.
Amonyak gazı suda çözülebilir. Bu tür amonyak sıvı amonyak veya sulu amonyak olarak adlandırılır. Açık havaya maruz kaldığında sıvı amonyak hızla gaza dönüşür.
Amonyak tarlalarda doğrudan toprağa uygulanır ve çiftlik ürünleri, çimenler ve bitkiler için gübre yapmak için kullanılır. Birçok ev ve endüstriyel temizleyici amonyak içerir.
Amonyak, susuz kimyasal özellikler, kullanımlar, üretim yöntemleri
GÖRÜNÜM
KESKİN KOKULU, RENKSİZ, BASINÇLI SIVILAŞTIRILMIŞ GAZ.
FİZİKSEL RİSKLER
Gaz havadan daha hafiftir.
KİMYASAL TEHLİKELER
Cıva, gümüş ve altın oksitlerle şoka duyarlı bileşiklerin oluşumu. Güçlü taban. Asitlerle şiddetli reaksiyona girer. aşındırıcı. Güçlü oksitleyici maddeler ve halojenlerle şiddetli reaksiyona girer. Bakır, alüminyum, çinko ve alaşımlarına saldırır. Isının gelişmesiyle suda çözünür.
İSTİHDAM LİMİTLERİ
TLV: 25 ppm (TWA olarak); 35 ppm (STEL olarak) (ACGIH 2005).
MAK: 20 ppm, 14 mg/m? Pik sınırlaması: gezinim faktörü I (2); Hamilelik: C grubu; (DFG 2005).
KABUL YOLLARI
Solunum yoluyla vücuda emilebilir.
SOLUNUM TEHLİKESİ
Gaz, kaptan çıktığı zaman havadaki zararlı bir konsantrasyona çok çabuk ulaşır.
KISA SÜRELİ MARUZ KALMA ETKİLERİ
KISA SÜRELİ MARUZ KALMA ETKİLERİ:
Bu madde gözler, cilt ve solunum yolları için aşındırıcıdır. Yüksek konsantrasyonların solunması akciğer ödemine yol açabilir (nota bakınız). Hızlı buharlaşma donmalara neden olabilir.
KAÇAK
Tehlike bölgesini terk edin! Bir uzmana danışın! Havalandırma. Su jetini ASLA sıvıya doğrultmayın. Gazı ince bir su spreyi ile söndürün. Kişisel koruyucu ekipman: bağımsız solunum aparatlı gaz geçirmez kimyasal koruyucu giysi.
Tanım
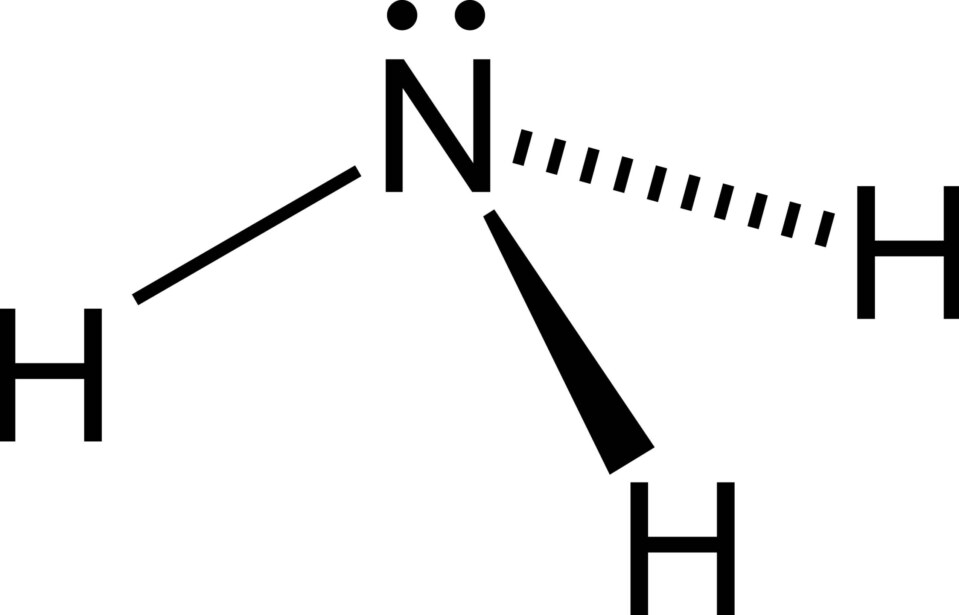
Amonyak, en önemli endüstriyel inorganik kimyasallardan biri olan renksiz, keskin kokulu bir gazdır. Gübrelerde, soğutucularda, patlayıcılarda, temizlik maddelerinde ve çok sayıda başka kimyasal üretmek için hammadde olarak yaygın olarak kullanılmaktadır. Amonyak, yılda üretilen ilk 10 kimyasaldan biri olarak yer almaktadır.
Amonyak Kimyasal özellikler
Standart sıcaklık ve basınçta, NH3, küçük konsantrasyonlarda nüfuz eden, keskin keskin bir kokuya sahip renksiz bir gazdır ve yüksek konsantrasyonlarda solunduğunda boğucu bir his yaratır. Formül ağırlığı 17.03 ve sp gr 0.817 (79°C’de) ve 0.617 (15°C’de). Amonyak suda çok çözünür, çözeltinin donma sıcaklığında yaklaşık %45 NH3 (ağırlık) ve standart koşullarda yaklaşık %30 (ağırlık) içeren doymuş bir çözeltidir. Suda çözünen amonyak, güçlü alkali bir amonyum hidroksit çözeltisi, NH4OH oluşturur. Tek değerli radikal, K + ve Na + gibi, asitlerle kuvvetli bir şekilde reaksiyona girerek tuzlar oluşturur. Amonyak mükemmel bir susuz elektrolitik çözücüdür ve iyonlaştırıcı gücü suyunkine yakındır. Amonyak yeşilimsi sarı bir alevle yanar.
Kimyasal özellikler
Amonyak, keskin, boğucu bir kokuya sahip renksiz, kuvvetli alkali ve son derece çözünür bir gazdır.
Güçlü amonyak çözeltisi, son derece keskin, karakteristik bir kokuya sahip berrak, renksiz bir sıvı olarak oluşur. Havadan daha hafiftir ve çoğu azotlu organik maddenin ayrışmasının bir sonucu olarak oluşur. PhEur 6.0, konsantre amonyak çözeltisinin %25,0’dan az olmayan ve ağ/ağ %30’dan fazla olmayan amonyak (NH3) içerdiğini belirtir. USP32– NF27, güçlü amonyak çözeltisinin %27,0’dan az olmayan ve ağırlıkça %31,0’dan fazla olmayan amonyak (NH3) içerdiğini belirtir.
Önemli bir ticari kimyasal olan susuz amonyak, gübre, HN03, akrilonitril ve diğer ürünlerin imalatında ve elektrolitik bir çözücü olarak kullanılır.
Amonyak Fiziksel özellikler
Delici, keskin, boğucu bir kokuya sahip renksiz gaz. 45.8 ppm bir deneysel olarak belirlenen bir koku eşik konsantrasyonu v Leonardos ve arkadaşları tarafından rapor edilmiştir. (1969). 11.6 mg / m bir saptama koku travers konsantrasyonu 3 (16.7 ppm hac ) deneysel Nishida ve diğerleri ile belirlenmiştir. (1974).
Amonyak Tarihi
Orta Çağ boyunca amonyak, hayvan gübresi, toynak ve boynuzun damıtılmasıyla üretildi. Boynuzdan hazırlanması ona başka bir isim verdi: hartshorn ruhu. Joseph Priestley (1733-1804), 1774’te amonyağı izole etti ve bileşik alkali hava olarak adlandırdı. Modern adı amonyak 1782 yılında İsveçli kimyager Torbern Bergman (1735-1784) tarafından bileşiğe verildi. Kesin kimyasal bileşim 1785 yılında Claude-Louis Berthollet (1748-1822) tarafından belirlendi. 19. yüzyılda kömür katranının damıtılmasından amonyak elde edildi. Azotlu gübrelerin tarımdaki önemi 1800’lerin ortalarında belirlendi ve bu, kimya endüstrisinin büyümesiyle birleştiğinde azotu sabitlemek için bir yöntem bulmak için teşvik sağladı.
Kullanmak
Amonyak, gübre, patlayıcılar, plastikler ve diğer kimyasallar için önemli bir hammaddedir. Amonyağın birincil kullanımı gübre üretimidir ve amonyağın yaklaşık %70’i bu amaç için kullanılmaktadır. Üretilen başlıca gübreler arasında amonyum nitrat, amonyum sülfat ve üre bulunur.
Kullanmak
NH 3 (amonyak), Haber Bosch olarak adlandırılan süreçte üretilir. Bu endüstriyel proses, katalizör olarak ince bölünmüş demir ve 50 atm basınçta yaklaşık 450 °C’lik bir reaksiyon sıcaklığı kullanır. Amonyak, modern yaşam tarzımız için önemli olan gübre, nitrik asit, naylon ve daha birçok ürünün üretiminde kullanılmaktadır.
K 2 (g) + 3H 2 (g) → 2NH 3 (g)
Kullanmak
Gübre, korozyon önleyici, su kaynaklarının arıtılması, ev temizleyicilerinin bileşeni, soğutucu olarak. Nitrik asit, patlayıcılar, sentetik elyaf, gübre imalatı. Kağıt hamuru ve kağıt, metalurji, kauçuk, yiyecek ve içecek, tekstil ve deri endüstrilerinde.
Kullanmak
Amonyak, büyük tonajlı bir endüstriyel üründür ve başlıca kullanımını nitrik asit ve gübre üretiminde bulur. Özellikle büyük endüstriyel tesisler için en yaygın kullanılan soğutucudur.
Amonyak Hazırlık Metodu
Amonyak sentezi için Haber süreci, nitrojen ve hidrojenin reaksiyonuna dayanır: N 2 (g) + 3H 2 (g) ? 2NH3 (g) . Reaksiyondaki nitrojen, sıvılaştırma yoluyla havadan nitrojenin ayrılmasıyla elde edilir ve hidrojen, buhar reformasyonu ile doğalgazdan elde edilir: CH 4 (g) + H 2 O (g) → H 2 (g) + CO (g)Le Chatelier ilkesine göre, amonyak üretimi yüksek basınç ve düşük sıcaklık tarafından desteklenir. Haber süreci tipik olarak 200 ile 400 atmosfer arasındaki basınçlarda ve 500 °C sıcaklıklarda gerçekleştirilir. Amonyağın ticari üretiminde, NH3 üretilirken sürekli olarak uzaklaştırılır.
tanım
ChEBI: Üç hidrojen atomuna kovelent olarak bağlanmış tek bir nitrojen atomundan oluşan bir azan.
Hazırlık metodu
Amonyak, ticari olarak esas olarak, bir katalizör varlığında yüksek basınç ve sıcaklık altında birleştirilen kurucu elementleri olan nitrojen ve hidrojenden sentez yoluyla elde edilir. Amonyak çözeltisi, amonyak gazının suda çözülmesiyle üretilir.
Hava ve Su reaksiyonları
Isının evrimi ile suda çözün. Üretilen ısı miktarı büyük olabilir.
Amonyak Tepkimeleri
AMONYAK bir bazdır. Tüm asitlerle ekzotermik olarak reaksiyona girer. Şiddetli reaksiyonlar mümkündür. Halojenlerle temas halinde patlayan bileşikler oluşturmak için gümüş oksit veya cıva ile kolayca birleşir. Kloratlarla temas ettiğinde Amonyak patlayıcı amonyum klorat oluşturur [Kirk-Othmer, 3. baskı, Cilt 2, 1978, s. 470]. Flor, klor, brom ve iyot ve bazı interhalojen bileşiklerle (brom pentaflorür, klor triflorür) şiddetli reaksiyona girer veya patlayıcı ürünler üretir. Ağartma tozunun (hipoklorit solüsyonu) amonyak solüsyonları ile karıştırılması zehirli/patlayıcı amonyak triklorür buharları üretir. 1,2-dikloroetan (sıvı amonyak ile), bor halojenürler, etilen oksit (polimerizasyon), perkloratlar veya güçlü oksitleyiciler (kromil klorür, krom trioksit, kromik asit, nitrik asit, hidrojen peroksit, kloratlar, flor, nitrojen oksit, sıvı oksijen). Gümüş klorür, gümüş oksit, gümüş nitrat veya gümüş azid ile reaksiyona girerek patlayıcı gümüş nitrür oluşturur. Bazı ağır metal bileşikleri (cıva, altın (III) klorür) ile reaksiyona girerek kuruduğunda patlayabilecek malzemeler oluşturabilir. [Bretherick, 5. baskı, 1995, s. 1553].
Tehlike
Konsantre dumanların solunması ölümcül olabilir. Orta derecede yangın riski, havada patlama limitleri %16–25. Gümüş veya cıva ile temas halinde patlayıcı bileşikler oluşturur. Göz hasarı ve üst solunum yolu tahriş edici.
Sağlık tehlikesi
Amonyak gözleri, burnu ve solunum yollarını yoğun şekilde tahriş eder. Toksik etkiler arasında gözyaşı, solunum sıkıntısı, göğüs ağrısı ve pulmoner ödem bulunur. Koku ile 10 ppm’lik bir konsantrasyon tespit edilebilir; gözlerde ve burunda tahriş yaklaşık 200 ppm’de algılanabilir. 3000 ppm’ye birkaç dakika maruz kalmak dayanılmaz olabilir, bu da deride ciddi kabarcıklara, akciğer ödemine ve asfiksiye neden olarak ölüme yol açar. Nem ile reaksiyona girerek kostik amonyum hidroksit oluşturduğu için aşındırıcı bir cilttir. Uzun süreli maruz kalma dokuların tahribatına neden olabilir
LC50 değeri, soluma (fare): 4200 ppm/saat.
Yangın tehlikesi
Amonyağın çeşitli kimyasallarla karıştırılması ciddi yangın tehlikelerine ve/veya patlamalara neden olabilir. Kaptaki amonyak ateşin sıcaklığında patlayabilir. Gümüş ve altın tuzları, halojenler, alkali metaller, nitrojen triklorür, potasyum klorat, kromil klorür, oksijen halojenürler, asit buharları, azidler, etilen oksit, pikrik asit ve diğer birçok kimyasal dahil olmak üzere birçok malzeme ile uyumlu değildir. Diğer kimyasallar ve su ile karıştırma. Tehlikeli polimerizasyon oluşmayabilir.
Yanıcılık ve Patlayıcılık
Amonyak buharı hafif yanıcıdır (NFPA derecesi = 1) ve yalnızca güçlükle tutuşur. Amonyak, hava ile %16-25 aralığında patlayıcı karışımlar oluşturur. Amonyak yangınları için su, karbondioksit veya kuru kimyasal söndürücüler kullanılmalıdır.
Tarımsal Uygulama da Amonyak
Susuz amonyak, bir demir katalizör varlığında yüksek sıcaklıklarda (450 ila 500’C) ve basınçta (yaklaşık 500 atm) 3:1 oranında hidrojen ile nitrojeni reaksiyona sokarak Haber-Bosch prosesi ile yapılan bir amonyum gübresidir. potasyum ve alümina tarafından teşvik edilir. Havadan türetilen nitrojen ve (a) sentez gazından, (b) naftanın, kömürün veya kok kömürünün buharla reformasyonundan (c) linyitten veya (d) suyun elektrolizinden elde edilen hidrojen, kullanımdan önce standart prosedürlerle saflaştırılır. Bu şekilde üretilen susuz amonyak doğrudan gübre olarak kullanılabilir. Ayrıca amonyağın nitrik, sülfürik ve fosforik asitlerle reaksiyona girmesiyle önemli gübreler olan amonyum tuzlarına dönüştürülebilir. Susuz amonyak da bir diğer önemli azot kaynağı olan üreyi elde etmek için karbondioksit ile reaksiyona girer.
Susuz amonyak önemli bir sıvı gübredir ve azotlu gübreler arasında en yüksek azot içeriğine (yaklaşık %82) sahip olan en ucuz azot kaynağıdır. Ancak, güvenlik ve çevresel hususlar nedeniyle, birçok bayi ve kullanıcı artık diğer nitrojen kaynaklarına geçiyor.
Susuz sıvı amonyak, donma ve yakıcı etkisiyle dokunun dehidrasyonuna ve cilde, akciğerlere ve gözlere ciddi hasara neden olabilir. Düşük buhar basıncı nedeniyle (10 ℃’de 6 bar, 20 ℃’de 9 bar ve 3O ℃’de 12 bar), susuz amonyak basınçlı kaplarda depolanmalı ve taşınmalıdır.
Susuz amonyağın uçucu yapısı nedeniyle, etkili olması ve amonyak kaybını azaltmak için toprak yüzeyinin 15 ila 30 cm altına bir aplikatör ile enjekte edilmelidir. Amonyak kaybı toprak tipine, nem içeriğine ve aplikatörün enjekte edildiği derinliğe bağlıdır.
Amonyak aplikatörlerinin boyutları, 5 sıralı küçük kulelerden 20 m’ye (65 fit) kadar namlu genişliğine sahip ve yüksek güçlü traktörler tarafından çekilen büyük kulelere kadar değişir. Susuz amonyak genellikle değişken bir orifis tipi sayaç veya bir pistonlu pompa ile ölçülür.
Susuz amonyağın fiziksel özellikleri, bütan veya propan gazı gibi basınç altındaki diğer sıvılara biraz benzer. Susuz amonyağın işlenmesindeki zorluklar nedeniyle, amonyak, üre, amonyum fosfat veya diğer çözünür katı nitrojen malzemelerin su çözeltileri yaygın olarak kullanılmaktadır. Susuz amonyak ayrıca sığır ve koyunlar için protein yemlerinin hazırlanmasında ve mekanik hasadı kolaylaştırmak için pamuk yapraklarının dökülmesini hızlandırmak için yaprak dökücü olarak kullanılır.
İlaç Uygulamaları
Amonyak çözeltisi tipik olarak farmasötik uygulamalarda seyreltilmeden kullanılmaz. Genellikle tamponlama maddesi olarak veya çözeltilerin pH’ını ayarlamak için kullanılır. En yaygın olarak, daha seyreltik amonyak çözeltileri üretmek için amonyak çözeltisi (konsantre form) kullanılır.
Terapötik olarak, seyreltik amonyak çözeltisi ‘kokulu tuzlarda’ refleks uyarıcı olarak, rubefacient olarak ve böcek ısırıklarını veya sokmalarını nötralize etmek için bir karşı tahriş edici olarak kullanılır.
Endüstriyel kullanım
Amonyak (NH3) keskin, nüfuz edici bir kokuya sahip alkali bir gazdır. Azot ve hidrojenin basınç altında bir katalizör varlığında reaksiyona girmesi amonyak üretir. Gaz halindeki amonyak, hacimce %15-28 konsantrasyonlarda havada yanıcıdır. Susuz sıvı amonyak, güçlü bir kokuya sahip renksiz bir sıvıdır. Amonyak, metal iyonlarına karşı benzersiz kimyasal özelliklerinden dolayı öncelikle hidrometalurjik işlemede kullanılır. Mineral işleme endüstrisinde, amonyak pH düzenleyici olarak nadiren kullanılır. Dünyada bir bakır/çinko cevherinin arıtılmasında pH düzenleyici olarak amonyağı kullanan tek bir işletme tesisi vardı.
Malzeme Kullanımları
En yaygın metaller kuru amonyaktan etkilenmez. Bununla birlikte, su buharı ile birleştiğinde, amonyak bakır, çinko veya ana alaşım elementi olarak bakır içeren alaşımlara saldıracaktır. Bu nedenle bu malzemeler amonyak ile temas halinde kullanılmamalıdır. Bazı yüksek mukavemetli çelikler, amonyak hizmetinde stres korozyonu çatlaması geliştirmiştir, ancak bu tür çatlama, inhibitör olarak amonyak içinde ağırlıkça yüzde 0,2 su kullanılarak önlenebilir. Amonyak depolama tankları ve bunların vanaları ve bağlantı parçaları genellikle çelikten yapılır.
Emniyet
Güçlü amonyak çözeltilerinin yutulması çok zararlıdır ve ağızda, boğazda ve gastrointestinal sistemde şiddetli ağrıya ve ayrıca öksürük, kusma ve şok ile birlikte şiddetli lokal ödemlere neden olur. Yemek borusu ve midedeki yanıklar perforasyona neden olabilir. Buharın solunması hapşırmaya, öksürmeye ve yüksek konsantrasyonda akciğer ödemine neden olur. Asfiksi bildirilmiştir. Buhar gözleri tahriş eder. Konjonktiva ve mukoza zarlarına uygulandığında güçlü çözeltiler zararlıdır. Böcek ısırıklarını tedavi etmek için kullanılan seyreltik amonyak çözeltilerinin bile topikal uygulaması, özellikle sonraki pansuman ile birlikte kullanıldığında yanıklara neden olmuştur.
Bir eksipiyan olarak kullanıldığında, amonyak çözeltisi genellikle bir formülasyonda yüksek oranda seyreltilmiş biçimde bulunur.
olası maruz kalma
Amonyak, nitrojen içeren birçok bileşik için bir nitrojen kaynağı olarak kullanılır. Gübreler için amonyum sülfat ve amonyum nitrat üretiminde kullanılır; ve nitrik asit, soda imalatında; sentetik üre, sentetik lifler; boyalar; ve plastikler. Aynı zamanda bir soğutucu olarak ve petrol arıtma ve kimya endüstrilerinde kullanılmaktadır. Birçok ilaç ve pestisit üretiminde kullanılmaktadır. Diğer mesleki maruziyet kaynakları arasında aynaların gümüşlenmesi, tutkal yapımı, derinin tabaklanması; ve nitrürleme fırınları çevresinde. Amonyak, kömür damıtmasında bir yan ürün olarak ve buharın kalsiyum siyanamid üzerindeki etkisiyle ve azotlu maddelerin ayrışmasından üretilir.
Fizyolojik etkiler
Kronik solunum yolu hastalığı olan veya amonyağa aşırı duyarlılık gösteren kişiler, amonyağa maruz kalacakları yerlerde çalıştırılmamalıdır.
Amonyak kümülatif bir metabolik zehir değildir; amonyum iyonları aslında canlı sistemlerin önemli bileşenleridir. Ancak ortam atmosferinde bulunan amonyak göz, burun, boğaz ve akciğerlerin mukoz zarları üzerinde yoğun tahriş edici etkiye sahiptir. Yüksek amonyak seviyeleri dokular üzerinde aşındırıcı etkiler üretebilir ve nefes almayı engelleyecek şekilde gırtlak ve bronş spazmlarına ve ödemlere neden olabilir. Amonyak keskin kokusu koruyucu bir uyarı sağlar ve insanlar bilinçli oldukları sürece önemli ölçüde kirlenmiş havayı solumaktan kaçınabilirler.
Kaynak
Amonyak, kömür, akaryakıt, doğal gaz, odun, bütan ve propanın bir yanma ürünü olarak salınır (alıntı, Verschueren, 1983).
Amonyak, doğal olarak soya fasulyesinde (8.600 ppm), çuha çiçeği tohumlarında (2.300-2.455 ppm), kuzu etinde ve tütün yapraklarında bulunur (Duke, 1992).
Çevresel kader
Kimyasal / Fiziksel. Asetaldehit, etilen oksit, etilen diklorür ile şiddetli reaksiyona girer (Patnaik, 1992).
Suda çözünür amonyum tuzları oluşturan asitlerle reaksiyona girer.
depo
Havaya maruz kaldığında, amonyak çözeltisi hızla amonyak kaybeder. Amonyak çözeltisi iyi kapatılmış bir kapta, havadan korunarak, serin ve kuru bir yerde saklanmalıdır. Depolama sıcaklığı 208 ℃’yi geçmemelidir.
Sevk / Nakliye
Tank arabalarında, tankerlerde, mavnalarda ve çelik silindirlerde sevk edilir. Etiketleme ve kısıtlamalar konsantrasyona göre değişir: NA1005 Amonyak, susuz, Tehlike Sınıfı: 2.2; Etiketler: 2.2-Yanmaz sıkıştırılmış gaz, Evsel (ABD), Soluma Tehlikesi (Özel Hüküm 13). UN1005 Amonyak, susuz, Tehlike Sınıfı: 2.3; Etiketler: 2.3-Zehirli Gaz, 8-Aşındırıcı malzeme Uluslararası, Soluma Tehlike Bölgesi D. UN2672 Amonyak çözeltileri, bağıl yoğunluk suda 0,880 ve 0,957 @ 15 C arasında, %0,10 ile ancak DEĞİL. %35 amonyak, tehlike sınıfı: 8; Etiketler: 8-Aşındırıcı malzeme. UN2073 Amonyak çözeltisi, bağıl yoğunluk suda 0.880 @ 15 C’den az, ile. %35 ama DEĞİL. %50 amonyak, Tehlike Sınıfı: 2.2; Etiketler: 2.2-Yanmaz sıkıştırılmış gaz. Not: Amonyum hidroksit, CAS1336-21-6, Kayıt A: 0110 için de kullanılır.
arıtma yöntemi
Sıvıyı kurutun ve sodyum ile çelik bir silindirde saklayın, ardından sıvı hava vasıtasıyla damıtın ve yoğunlaştırın, yoğunlaşmayan gazlar pompalanır.Bir silindirden sıvı NH3 elde etmek için silindiri ters çevirin. aşağı indirin (yani valf alttayken, onu bu konumda sabitlemek için metal bir ayak kullanın) ve plastik bir boruyu musluktan çalışır durumdaki verimli bir çeker ocak içine yerleştirilmiş bir ölçüm silindirine yönlendirin. Musluğu açın ve amonyağın serbest kalmasına izin verin.
İlk başta gaz ve sıvı sıçrayacaktır (plastik tüpün sağlam olduğundan emin olun), ancak yakında sıvı ölçüm silindirine damlayacaktır. Yüksek gizli buharlaşma ısısı, amonyağı soğutur, böylece sıvı soğuk kalır ve şiddetli bir şekilde kaynamaz. Amonyak kuru olarak isteniyorsa gerekli önlemler alınmalıdır, i. e. gazın kaba CaO peletleri ile dolu tüplerden akmasına izin verilir. AMONYAK (gaz, sıvı veya sulu çözelti) çok tahriş edicidir ve koku alma felcine (geçici veya kalıcı) yol açabileceğinden herhangi bir miktarda solunmamalıdır.
uyumsuzluklar
Amonyak çözeltisi, sülfürik asit veya diğer güçlü mineral asitlerle kuvvetli bir şekilde reaksiyona girer ve reaksiyon önemli ölçüde ısı üretir; karışım kaynar.
Atık bertarafı
Su ile seyreltin, HCl ile nötralize edin ve kanalizasyona boşaltın. Geri kazanım, kağıt üretimi, tekstil işleme, gübre üretimi ve kimyasal işlem atıkları için göz önünde bulundurulması gereken bir bertaraf seçeneğidir.
Düzenleyici statü
FDA Aktif Olmayan Bileşenler Veritabanına dahildir (oral süspansiyonlar, topikal preparatlar). İngiltere’de ruhsatlı parenteral olmayan ilaçlara dahildir. Kanada Kabul Edilebilir Tıbbi Olmayan Malzemeler Listesine dahil edilmiştir.
MEVCUT SINIFLAR
Amonyak için hiçbir emtia sınıfı spesifikasyonu endüstri için standart olarak yayınlanmamıştır.


Yorum yap